
Производство и применение платины.
Историческая справка.
“Белое золото”, “гнилое золото”… Под этими названиями платина фигурирует в литературе XVIII в. Этот металл известен давно, его белые тяжелые зерна находили при добыче золота. Из-за высокой тугоплавкости он оказался ни на что не пригодным и лишь затруднял очистку золота. Название “платина” возникло вследствие сходства этого металла с серебром, название которого на испанском языке “plata”, что означает “серебришко”, “плохое серебро”. Вплоть до XVIII в. этот ценнейший металл вместе с пустой породой выбрасывали в отвал, а на Урале и в Сибири зерна самородной платины использовали как дробь при стрельбе.
В Европе платину стали изучать с середины XVIII в., когда испанский математик Антонио де Ульоа привез образцы этого металла с золотоносных месторождений Перу. Были исследования, были споры - простое ли вещество платина или “смесь двух известных металлов - золота и железа”. Обстоятельное изучение платины в 1752 г. провел шведский химик Хенрик Шеффер, который доказал, что она является не смесью, а новым химическим элементом.
В 1773-1774 гг. М. де-Лиль получил ковкую форму платины. В 1783 г. Шабано запонтетовал процесс получения ковкой платины. Начиная со второй половины XVIII в. платиной, ее свойствами, методами переработки и использования стали интересоваться многие химики-аналитики и технологи, в том числе и ученые Петербургской академии наук. Наиболее важные работы в этой области в первой половине XIX в. - это создание методов получения ковкой платины.
Всемирную известность приобрели труды русского ученого и общественного деятеля А.А. Мусина-Пушкина (1760-1805). Еще в 1797 г. он открыл новые способы получения амальгамы платины, а затем разработал совершенные методы ее ковки и очистки от железа. Работы Мусина-Пушкина были продолжены Архиповым, Варвинским, Любарским, Соболевским и др.
В 1826 г. выдающийся инженер П.Г. Соболевский вместе с В.В. Любарским разработал простой и надежный способ получения ковкой платины. Самородную платину растворяли в царской водке, а из этого раствора, добавляя NH4Cl, осаждали хлороплатинат аммония (NH4)2[PtCl]. Этот осадок промывали, а затем прокаливали на воздухе. Полученный спекшийся порошок (губку) прессовали в холодном состоянии, а затем прессованные брикеты прокаливали и ковали. Этот способ позволял делать из уральской платины изделия высокого качества. Таким образом, Соболевский заложил основы порошковой металлургии.
21 марта 1827 г. в конференц-зале Петербургского горного кадетского корпуса на многолюдном торжественном собрании Ученого комитета по горной и соляной части были показаны изготовленные новым методом первые изделия из русской платины. Открытие П.Г. Соболевского и В. В. Любарского получило мировую известность. В 1828 г. Соболевский описал свой способ получения ковкой платины в Петербургском “Горном журнале” под названием: “Об очищении и обработке сырой платины”.

Монеты из платины, Российская Империя, 1832 год
Благодаря предприимчивости министра финансов Е. Ф. Канкрина с 1828 г. в России стали выпускать платиновые монеты достоинством в 3, 6 и 12 рублей; на это было затрачено около 14.5 т платины.
В 1913 г. под руководством Н. Н. Барабошкина на базе исследовательских работ, проведенных в лаборатории Петербургского горного института, в г. Екатеринбурге начали строительство аффинажного завода для переработки добываемой шлиховой платины. В 1916 г. начали выпускать лишь губчатую платину и только в 1923 г. стали выделять спутники платины.
Производство и потребление.
Таблица 1. Производство платины, кг
| Страна | 1960 г. | 1965 г. | 1970 г. | 1975 г. | 1980 г. | 1985 г. |
| ЮАР | 8900 | 16 600 | 33 200 | 57 600 | 68 400 | 71 000 |
| Канада | 6500 | 6300 | 6200 | 5400 | 5400 | 4700 |
| США | 318 | 354 | 250 | 200 | 220 | 250 |
Важнейшие области применения платины - химическая и нефтеперерабатывающая промышленность. В качестве катализаторов различных реакций используется около половины всей потребляемой платины. В химической промышленности платину используют в процессе производства азотной кислоты (по оценочным данным на эти цели ежегодно идет 10-20 % мирового потребления платины).
В нефтеперерабатывающей промышленности с помощью платиновых катализаторов на установках каталитического риформинга получают высокооктановый бензин, ароматические углеводороды и технический водород из бензиновых и лигроиновых фракций нефти.
Таблица 2. Потребление платины по отраслям в США в количественном и процентном соотношениях.
| Платина | 1960 г. | 1965 г. | 1970 г. | 1975 г. | 1980 г. | |||||
| Всего: | 10 007 | 13 484 | 14 558 | 21 065 | 34 800 | |||||
| В том числе по отраслям: | ||||||||||
| Автомобильная | - | - | - | - | - | - | 8491 | 40% | 15 200 | 44% |
| Химическая | 2216 | 22% | 4093 | 30% | 4378 | 30% | 4629 | 22% | 5600 | 16% |
| Нефтеперерабатывающая | 1109 | 12% | 2526 | 19% | 5595 | 38% | 3359 | 16% | 5500 | 16% |
| Электротехническая | 3325 | 33% | 3322 | 25% | 2562 | 18% | 2290 | 11% | 3800 | 11% |
| Стекольная | 1847 | 18% | 1617 | 12% | 1071 | 7% | 1052 | 5% | 2400 | 7% |
| Медицинская | 494 | 5% | 825 | 6% | 217 | 2% | 532 | 3% | 1100 | 3% |
| Ювелирная | 1016 | 10% | 1101 | 8% | 735 | 5% | 712 | 3% | 1200 | 3% |
В автомобильной промышленности платину также используют каталитические свойства этого металла - для дожигания и обезвреживания выхлопных газов, с целью оснащения автомобилей специальными устройствами по очистке выхлопных газов от вредных примесей.
Стабильность электрических, термоэлектрических и механических свойств плюс высочайшая коррозионная и термическая стойкость сделали этот металл незаменимым для современной электротехники, автоматики и телемеханики, радиотехники, точного приборостроения.
Незначительная часть платины идет в медицинскую промышленность. Из платины и ее сплавов изготовляют хирургические инструменты, которые, не окисляясь, стерилизуются в пламени спиртовой горелки. Некоторые соединения платины используют против различных опухолей. По структуре большинство из этих веществ - это неэлектролиты, цис-изомеры, производные двухвалентной платины. Самым эффективным соединением считается цис-дихлородиаминоплатина (II) [Pt(NH3)2Cl2]. Это активное в химическом соотношении вещество, в котором ионы Cl– частично замещаются молекулами воды с образованием иона [Pt(NH3)2(H2O)2]2+. Процесс ионизации дихлородиаминоплатины идет главным образом в клетках, где концентрация хлоридов ниже, чем в сыворотке крови. Продукт гидролиза [Pt(NH3)2Cl2] реагирует с азотистыми основаниями ДНК как бифункциональный агент, вызывая образование поперечных связей между нитями ДНК. Это служит основной причиной нарушения деления и гибели опухолевых клеток. Дополнительным механизмом противоопухолевого действия дихлородиаминоплатины является активация иммунитета организма.
Таблица 3. Цены на платину, долл. за 1 тр. унцию.
| 1960 г. | 1965 г. | 1970 г. | 1975 г. | 1980 г. | 1985 г. | нояб. 1994 | нояб. 1995 |
| 83,5 | 98 | 132,5 | 170 | 420 | 480 | 407-416 | 406-407 |
Рост спроса на платину в мире является залогом высоких цен. По оценочным данным крупнейшей в мире компании по маркетингу металлов платиновой группы Johnson Matthey (JM) спрос на платину вырос в 1994 году на 7% и достиг уровня в 4.32 млн тройских унций. При этом с 1993 года сокращается потребление платины в промышленности. Однако рост заказов ювелиров и автомобилестроителей перекрывает это сокращение. Потребление платины в ювелирном производстве оценивается в 50 т. Второй фактор повышения спроса на этот металл - рост использования его в автокатализаторах. За это рынок платины должен быть благодарен партии зеленых, поскольку именно введение более строгих мер по ограничению вредных выбросов в атмосферу привело к тому, что почти все новые автомобили оснащаются автокатализаторами.
Таблица 4. Потребление платины в мире в 1993 г. (по информации Johnson Matthey), %.
| Нефтепереработка | 12 % |
| Ювелирная промышленность | 30 % |
| Инвестиции | 8 % |
| Производство стекла | 3 % |
| Электротехника | 4 % |
| Химическая промышленность | 5 % |
| Автокатализаторы | 35 % |
| Другие | 3 % |
Основные свойства платины.
Положение в периодической системе элементов.
Платина - символ Pt (лат. Platinum), химический элемент 6-го переходного периода периодической системы. Для него характерно заполнение 5d-электронных орбиталей при наличии одного или двух s-электронов на более высоких 6s-электронных орбиталях.
Таблица 5. Характеристика атомов платины.
| Характеристика | Платина |
| Порядковый номер | 78 |
| Конфигурация внешних электронных оболочек | 5d96s1 |
| Число неспаренных электронов | 2 |
| Атомная масса | 195.09 |
| Атомный объем, см3 | 9.10 |
| Эффективный атомный радиус, нм | Pt4+=0.064 |
| Потенциалы ионизации, В | 9.0; 18.56; (23.6) |
| Возможные степени окисления | 0, II, III, IV, VI |
| Характерные степени окисления | II, IV |
Будучи элементом переходного периода, платина характеризуется различными степенями окисления. В большинстве своих соединений платина проявляет степени окисления +2 и +4. Как в том, так и в другом состоянии, благодаря высоким зарядам, небольшим ионным радиусам и наличию незаполненных d-орбиталей, она представляет собой типичный комплексообразователь. Так, в растворах все его соединения, включая простые (галогениды, сульфаты, нитраты), превращаются в комплексные, поскольку в комплексообразовании участвуют ионы соединений, присутствующих в растворе, а также вода. Поэтому гидрометаллургия платины основана на использовании ее комплексных соединений.
Физические свойства.
Платина очень тугоплавкий и труднолетучий металл, кристаллизуется в гранецентрированные кубические (г. ц. к.) решетки. При воздействии на растворы солей восстановителями металл может быть получен в виде “черни”, обладающей высокой дисперсностью.
Платина в горячем состоянии хорошо прокатывается и сваривается. Характерным свойством является способность абсорбировать на поверхности некоторые газы, особенно водород и кислород. Склонность к абсорбции значительно возрастает у металла, находящегося в тонкодисперсном и коллоидном состоянии. Платина (особенно платиновая чернь) довольно сильно поглощает кислород: 100 объемов кислорода на один объем платиновой черни. Вследствии способности к абсорбции газов платину применяют в качестве катализаторов при реакциях гидрогенизации и окисления. Каталитическая активность увеличивается при использовании черни.
Таблица 6. Физические свойства.
| Характеристика | Pt |
| Плотность при 20°С, г/дм3 | 21.45 |
| Цвет | Серовато-белый, блестящий |
| Радиус атома, нм | 0.138 |
| Температура плавления, °С | 1769 |
| Температура кипения, °С | 4590 |
| Параметры кристаллической решетки при 20 °С, нм | а=0.392 |
| Удельная теплоемкость, Дж/(моль/К) | 25.9 |
| Теплопроводность при 25 °С, Вт/(м•К) | 74.1 |
| Удельное электросопротивление при 0°С, мкОм•см | 9.85 |
| Твердость по Бринеллю, МПа | 390-420 |
| Модуль упругости, ГПа | 173 |
Химические свойства.
Платина как элемент VIII группы может проявлять несколько валентностей: 0, 2+, 3+, 4+, 5+, 6+ и 8+. Но, когда идет речь об элементе № 78 почти также, как валентность, важна другая характеристика - координационное число. Оно означает, сколько атомов (или групп атомов), лигандов, может расположиться вокруг центрального атома в молекуле комплексного соединения. Для степени окисления 2+ и 4+ координационное число равно соответственно четырем или шести.
Комплексы двухвалентной платины имеют плоскостное строение, а четырехвалентной - октаэдрическое.
При обычной температуре платина не взаимодействует с минеральными и органическими кислотами. Серная кислота при нагреве медленно растворяет платину. Полностью платина растворяется в царской водке:
3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO+8H2O. (1)
При растворении получается гексахлороплатиновая, или платинохлористоводородная, кислота H2[PtCl6], которая при выпаривании раствора выделяется в виде красно-бурых кристаллов состава H2[PtCl6]•H2O. При повышенных температурах платина взаимодействует с едкими щелочами, фосфором и углеродом.
С кислородом платина образует оксиды (II), (III) и (IV): PtO, Pt203 и PtO2. Оксид PtO получается при нагревании порошка платины до 430°С в атмосфере кислорода при давлении 0.8 МПа. Оксид Pt2O3 можно получить при окислении порошка металлической платины расплавленным пероксидом натрия. Оксид PtO2 - порошок черного цвета - получается при кипячении гидроксида платины (II) со щелочью:
2Pt(OH)2=PtO2+Pt+2H2O. (2)
Гидроксид платины (IV) можно получить осторожным приливанием щелочи к раствору хлороплатината калия:
K2[PtCl6]+4KOH=Pt(OH)4+6KCl. (3)
Сернистое соединение PtS - порошок коричневого цвета, не растворимый в кислотах и царской водке; PtS2 - черный осадок, получаемый из растворов действием сероводорода, растворимый в царской водке.
Хлориды натрия часто используют в гидрометаллургии и аналитической практике. При 360°С воздействием хлора на платину можно получить тетрахлорид PtCl4, который при температуре выше 370°С переходит в трихлорид PtCl3, а при 435 °С распадается на хлор и металлическую платину; PtCl2 растворяется в слабой соляной кислоте с образованием платинисто-хлористоводородной кислоты H2[PtCl4], при действии на которую солей металлов получаются хлороплатиниты Me2[PtCl4] (где Me - K, Na, NH4 и т.д.).
Тетрахлорид платины PtCl4 при воздействии соляной кислоты образует платинохлористоводородную кислоту H2[PtCl6]. Соли ее - хлороплатинаты Me2[PtCl6]. Практический интерес представляет хлороплатинат аммония (NH4)2[PtCl]6 - кристаллы желтого цвета, малорастворимые в воде, спирте и концентрированных растворах хлористого аммония. Поэтому при аффинаже платину отделяют от других платиновых металлов, осаждая в виде (NH4)2[PtCl6].
В водных растворах сульфаты легко гидролизуются, продукты гидролиза в значительном интервале pH находятся в коллоидном состоянии. В присутствии хлорид-ионов сульфаты платины переходят в хлороплатинаты.
Поведение платины в обогатительных операциях.
Формы нахождения платины в рудах.
Платиновый самородок размером 35 × 23 × 14 мм и весом 112 гр., найденный в Кондёре, Хабаровский край
+ Щелкните по рисунку, чтобы увеличить!
Формы нахождения платины в рудах определяют ее поведение в последующих процессах обогащения. Поэтому их изучение имеет большое значение для выбора технологической схемы переработки платинусодержащих руд и концентратов.
Подсчеты содержания платины в земной коре были выполнены Кларком и Вашингтоном, а позднее И. и В. Ноддак. Первые принимали в расчет только ту платину, которая находится в россыпях и коренных ультраосновных породах, а вторые учитывали также платину, находящуюся в рассеянном состоянии. Иногда пользуются данными по распространенности платины, приводимыми Гольдшмидтом. Обобщение ряда исследований на основе многочисленных определений дано А. П. Виноградовым.
Таблица 7. Содержание платины в земной коре, %.
| По Кларку и Вашингтону | По И. и В. Ноддак | По Гольдшмидту | По А.П. Виноградову |
| 1.2•10-8 | 5•10-6 | 1•10-8 | 5•10-7 |
Платину добывают в “первичных” и “вторичных” месторождениях. К первым относятся открытые в 1908 г. канадские медноникелевые магнитные колчеданы в округе Садбери, месторождения Норильска и южноафриканские медноникелевые колчеданы в Трансваале; здесь платина присутствует в виде сульфидов. Вторичные месторождения обязаны своим появлением выветриванию первичных месторождений и последующему смыванию выветренных пород, причем платиновые металлы, имеющие большую плотность, оседали в определенных местах. Вторичные месторождения находятся в Колумбии. Но они утратили свое значение в 20-х годах прошлого века, когда на западных и восточных склонах Уральского хребта были найдены большие залежи платиновых руд. В уральских месторождениях минералы платиновых металлов генетически связаны с глубинными ультраосновными породами, главным образом, с дунитами.
Таблица 8. Средний состав уральской россыпной и коренной платины, %
| Тип месторождения | Pt |
| Россыпная | 77.5 |
| Коренная | 76.7 |
| Средний состав аффинируемой платины | 78.4 |
В канадских месторождениях платина встречается в виде сперилита PtAs2, куперита PtS и некоторых более редких минералов. Однако большая часть платиновых металлов находится в сульфидах в виде твердого раствора. Содержание платины в рудах достигает 1.5-2.0 г на 1 т руды.
Примерно такой же минералогический состав имеют южноафриканские руды, кроме того здесь найдена самородная платина и ферроплатина.
Каждому типу руд и их минеральным разновидностям свойственны свои особенности платиновой минерализации, обусловленные различной обогащенностью платиновыми металлами, различным соотношением платины, палладия, иридия, родия, рутения и осмия, а также различием форм нахождения металлов.
Многообразие типов руд и различие форм нахождения платиновых металлов в медно-никелевых рудах вызывает большие сложности с полнотой извлечения платиновых металлов в готовые концентраты, направляемые в металлургическую переработку.
Получение платиновых металлов из россыпей.
Россыпи платиновых металлов, образованные в результате разрушения коренных пород, известны во многих странах, но промышленные запасы в основном сосредоточены в Колумбии, Южной Африке, Бразилии и др.
Процесс извлечения платиновых металлов из россыпей сводится к двум группам операций: добыче песков и их обогащению гравитационными методами. Пески можно добывать подземными и открытыми способами; как правило, применяют открытые горные работы, выполняемые в два этапа: вскрыша пустой породы и добыча платинусодержащих песков. Добычу песков обычно совмещают с их гравитационным обогащением в одном агрегате, например, драге.
Добытая горная масса из дражных черпаков поступает в промывочную бочку, где осуществляется дезинтеграция и грохочение. Процесс дезинтеграции горной массы в бочке происходит посредством механического разделения и размыва ее водой при перекатывании породы внутри бочки и орошении напорной струей воды. Порода при этом разделяется на два продукта: верхний (галька, крупные камни, неразмытые камни глины) не содержит платины и направляется в отвал; нижний поступает последовательно на шлюзы, отсадочные машины и концентрационные столы. В результате обогащения получается шлиховая платина, содержащая до 70-90% платиновых металлов. Ее направляют на аффинаж.
Извлечение платины при обогащении сульфидных платинусодержащих руд
Технологические схемы извлечения платиновых металлов при обогащении вкрапленных руд определяются формами нахождения этих металлов в данном месторождении. Если платиновые металлы представлены самородной платиной и ферроплатиной, то в технологическую схему обогащения входит операция по получению гравитационного концентрата, содержащего повышенные концентрации платиновых металлов. Если в рудах платиновые металлы, в частности платина, находятся в виде магнитной ферроплатины, то обычно применяют магнитную сепарацию с последующей переработкой богатого продукта либо в отдельном цикле, либо совместно с никелевым концентратом в пирометаллургическом процессе. Первую схему применяют, например, для обогащения платинусодержащих руд Южной Африки.
Технологический процесс гравитационно-флотационного обогащения южноафриканских руд включает дробление исходной руды с последующим тонким измельчением ее в две стадии в шаровых мельницах, работающих в замкнутом цикле с гидроциклонами.
Свободные зерна самородной платины отделяют в цикле измельчения на шлюзах с кордероевым покрытием. Полученные концентраты подвергают перечистке на концентрационных столах с получением гравитационного концентрата, содержащего 30-35% Pt, 4-6% Pd и 0.5% других металлов платиновой группы.
Пульпу после выделения гравитационного концентрата сгущают и направляют на флотацию. Конечным продуктом флотации является концентрат, содержащий: 3.5-4.0% Ni, 2.0-2.3% Cu, 15.0% Fe, 8.5-10.0% S; сумма платиновых металлов 110-150 г/т. Этот концентрат поступает в металлургическую переработку. Извлечение платиновых металлов в цикле обогащения достигает 82-85 %.
Бедная вкрапленная руда месторождения Садбери подвергается дроблению, измельчению с последующей флотацией и магнитной сепарацией. В результате получается никелевый концентрат, содержащий платиновые металлы, медный концентрат, в состав которого входят золото и серебро, и пирротиновый концентрат, практически не имеющий благородных металлов.
При обогащении вкрапленных руд отечественных месторождений получаются два концентрата: медный и никелевый. Значительные потери металлов-спутников с хвостами обогащения объясняются тем, что они ассоциированы с пирротином, уходящим в отвал.
*
Основные технологические операции переработки медно-никелевых концентратов.
При обогащении сульфидных медно-никелевых руд получаются медный и никелевый концентраты, перерабатываемые по сложной технологической схеме (рис. 1).
Никелевый концентрат после агломерации или окатывания плавят в электротермических (реже отражательных) печах с получением штейна и шлака. Шлак на некоторых заводах после грануляции и измельчения подвергают флотации для извлечения взвешенных частиц штейна, содержащих платиновые металлы. Штейн, концентрирующий основную массу платиновых металлов, проходит операцию конвертирования на обеднительную электроплавку, и файнштейна, который медленно охлаждается, дробится, измельчается и флотируется с получением медного концентрата, перерабатываемого в медном производстве, и никелевого, направляемого на обжиг в печах кипящего слоя.
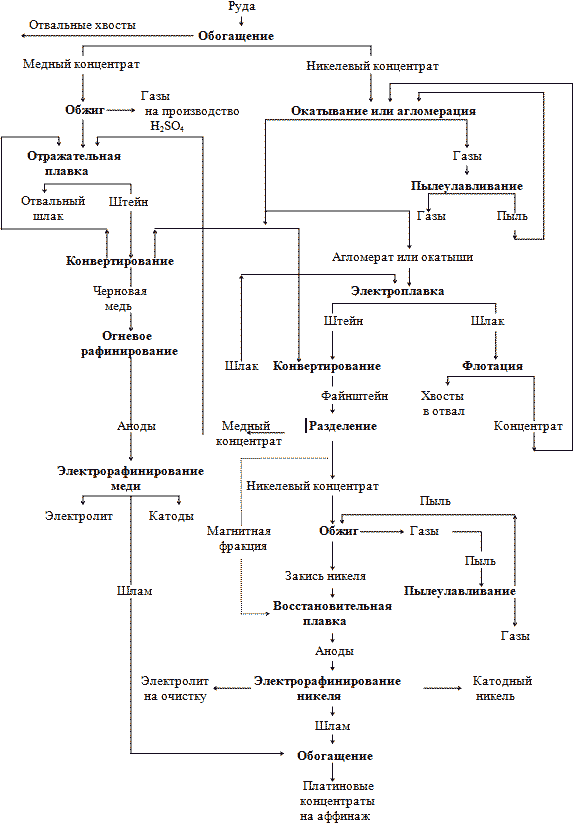
Рис. 1. Технологическая схема переработки сульфидных медно-никелевых руд.
При охлаждении файнштейна компоненты претерпевают кристаллизацию в следующей последовательности: первичные кристаллы сульфида меди → двойная эвтектика, состоящая из сульфидов меди и никеля, → тройная эвтектика, состоящая из сульфидов меди, никеля и медно-никелевого металлического сплава. Металлический сплав, выход которого на различных заводах составляет 8-15 %, коллектирует до 95% платиновых металлов, содержащихся в файнштейне. Поэтому на некоторых заводах металлическую фазу выделяют магнитной сепарацией и направляют на восстановительную плавку с получением анодов.
Полученную после обжига никелевого концентрата закись подвергают восстановительной плавке на аноды в дуговых электропечах. Аноды подвергают электрорафинированию; выпадающий на аноде шлам концентрирует основную массу платиновых металлов.
Платиновые металлы, находящиеся в медном концентрате, после обжига, отражательной плавки, конвертирования и огневого рафинирования концентрируются в медных анодах, после электрорафинирования переходят в медный шлам. Медный и никелевый шламы обогащают с получением концентратов, содержащих до 60% платиновых металлов. Эти концентраты направляют на аффинаж.
В последние годы для переработки медных и никелевых концентратов предложены высокоинтенсивные автогенные процессы: плавка в жидкой ванне, взвешенная плавка, кислородно-взвешенная плавка и др. Применяют также гидрометаллургическую переработку платинусодержащих сульфидных концентратов с использованием окислительного автоклавного выщелачивания, соляно- и сернокислое выщелачивание, хлорирование при контролируемом потенциале и другие процессы.
Таким образом, платиновые металлы в процессе пиро- и гидрометаллургической переработки подвергают воздействию окислителей при температурах до 1200-1300°С, действию кислот при высоких окислительных потенциалах среды, анодному растворению при значительных электроположительных потенциалах. Поэтому необходимо рассмотреть поведение этих металлов в различных процессах с целью создания условий для повышения извлечения их в принятых и проектируемых технологических схемах переработки платинусодержащих сульфидных медно-никелевых концентратов.
Физико-химические основы поведения платины при переработке сульфидного сырья
Пирометаллургические процессы.
При переработке сульфидных руд пирометаллургическими способами благородные металлы частично теряются с отвальными шлаками, пылями и газами. Для теоретической оценки возможности таких потерь и создания условий для их уменьшения большой интерес представляет зависимость свободных энергий образования оксидов и сульфидов благородных металлов от температур.
Таблица 9. Свободные энергии окисления сульфидов.
|
Реакция |
Ур-е свободной энергии ΔGТ, Дж/моль |
ΔGТ, Дж/моль О2 при температуре, К |
||
|
1173 |
1273 |
1573 |
||
|
PtS(тв)+2O2(г)=PtO2(тв)+SO2(г) |
-228000+87.5•Т |
- |
-227 |
-214 |
|
PtS(тв)+2O2(г)=PtO2(г)+SO2(г) |
-17600-7.5•Т |
-26 |
-27 |
-29 |
Агломерация.
В процессе агломерации концентрат подвергается окускованию и частичной десульфурации при 1000-1100°С, что сопровождается процессами разложения высших сульфидов и окисления получившихся продуктов кислородом воздуха.
Электроплавка сульфидного никель-медного концентрата осуществляется в электропечи, куда поступает концентрат, содержащий в зависимости от месторождения от 20 до 150 г/т платиновых металлов. В шихту вместе с окатышами и агломератом добавляют оборотные продукты и, в зависимости от состава исходного сырья, известняк или песчаник. Температура расплава на границе с электродом достигает 1300-1400°С. Пустая порода ошлаковывается; шлак сливают, гранулируют. На некоторых предприятиях его подвергают измельчению и флотации с целью более полного извлечения благородных металлов. Содержание благородных металлов в шлаке в зависимости от режима плавки и состава концентрата колеблется от 0.3 до 1.0 г/т. Штейн концентрирует основную массу платиновых металлов. Содержание их в штейне колеблется в пределах 100-600 г/т.
Процесс плавки протекает в основном в восстановительном режиме, поэтому потери платиновых металлов в этом процессе определяются механическими потерями мелких корольков штейна, взвешенных в шлаковой фазе. Эти потери могут быть устранены флотацией шлаков с извлечением платиновых металлов в сульфидный концентрат. При этом извлечение платины может достигать более 99.0%.
Конвертирование. Полученный при электроплавке штейн подвергается конвертированию. Конвертирование, цель которого состоит в возможно более полном удалении сульфида железа из никель-медных штейнов, осуществляется при температуре около 1200°С. Процесс протекает в сульфидных расплавах, где активность платиновых металлов очень невелика. Поэтому в процессе конвертирования в шлаковую фазу в очень незначительных количествах переходит платина (<0.5%), палладий (<0.5%), родий (<1.0%), иридий (<1.0%). Более того, конвертные шлаки перерабатываются в обеднительных печах, поэтому общие потери благородных металлов при конвертировании сравнительно малы.
При обжиге никелевого концентрата в печах кипящего слоя процесс окисления протекает весьма интенсивно и поэтому сопровождается значительными потерями металлов.
Восстановительная электроплавка закиси никеля на металлический никель не вызывает значительных потерь платиновых металлов. Механические потери их с пылями могут быть уменьшены в результате совершенствования системы пылеулавливания. Переход в шлаки не вызывает дополнительных потерь, так как шлаки в этом процессе являются оборотными продуктами.
Взвешенная плавка сульфидных материалов осуществляется в окислительной атмосфере при температуре около 1300°С.
Пирометаллургическая переработка медных концентратов, содержащих платиновые металлы, включая обжиг при 800-900°С, отражательную плавку, конвертирование и огневое рафинирование меди. В последние годы для переработки медных концентратов широкое применение получили автогенные процессы: взвешенная плавка и плавка в жидкой ванне.
Химические реакции и температурный режим обжига медных концентратов примерно те же, что при агломерации.
Гидрометаллургические процессы.
Платиновые металлы, содержащиеся в сульфидных медно-никелевых рудах, проходят через пирометаллургические операции, концентрируются в черновом металле и поступают на электролитическое рафинирование никелевых и медных анодов. Причем в зависимости от условий проведения этих операций большее или меньшее количество платиновых металлов может переходить в сборные или оборотные продукты, что в конце концов приводит к безвозвратным потерям.
Таблица 10. Формы нахождения платины в сульфатных, сульфатно-хлоридных и хлоридных растворах.
| Растворы | ||
| сульфатный | сульфатно-хлоридный | хлоридный |
| [Pt2(SO4)4•(H20)2]2- | [PtCl4]2- при φа<1.4 В; [PtCl6]2- при φа>1.4 В. |
[PtCl4]2- при φа<1.4 В; [PtCl6]2- при φа>1.4 В. |
При содержании в сплавах 0.01-1.0 % платинового металла, он замещает в кристаллической решетке сплава атомы никеля или меди, не образуя самостоятельных структур.
Известно, что в присутствии сульфидной, оксидной и металлической фаз платиновые металлы концентрируются в металлической фазе. Поэтому в никелевых и медных промышленных анодах, содержащих в качестве примесей сульфидные и оксидные фазы, платиновые металлы равномерно распределены в металлической фазе, образуя кристаллическую решетку замещения. Это приводит к образованию в решетке сплава микроучастков (зон) с более положительным равновесным потенциалом. Металлы в этих зонах не растворяются при потенциале работающего анода и выпадают в нерастворимый осадок - шлам. В случае повышения потенциала анода до величины, соответствующей потенциалу ионизации платиновых металлов, начинается переход этих металлов в раствор. Степень перехода будет увеличиваться, если в растворе платиновые металлы образуют стойкие комплексные соединения.
Таким образом поведение платиновых металлов при электрохимическом растворении анодов будет определяться потенциалом анода, составом раствора и природой растворяемого сплава.
Переработка платинусодержащих шламов.
При электролитическом рафинировании меди и никеля платиновые металлы концентрируются в анодных шламах, где их содержание в зависимости от состава исходных руд колеблется в широких пределах, от десятых долей до нескольких процентов.
В соответствии с основными теоретическими положениями в шламы при растворении анодов практически без изменения переходят оксиды и сульфиды цветных металлов. Поэтому основными фазовыми составляющими никелевого шлама являются сульфиды меди и никеля (α-Cu2S, β-Cu2S, Ni3S2, NiS), оксиды (NiO, CuO, Fe2O3, Fe3O4), ферриты (NiFe2O4, CuFeO2). Платиновые металлы в шламах представлены рентгеноаморфными металлическими формами.
Непосредственная переработка бедных по содержанию благородных металлов продуктов, в состав которых входят значительные количества цветных металлов, железа и серы, на аффинажных предприятиях не производится. Поэтому анодные шламы предварительно обогащают различными пиро- и гидрометаллургическими методами с получением концентратов платиновых металлов. Технологические схемы обогащения шламов, применяемые на различных заводах, различаются между собой.
Существующие схемы построены на селективном растворении цветных металлов, содержащихся в шламах. Благородные металлы при этом остаются в нерастворенном осадке, который направляют на аффинажное производство. Раствор, содержащий сульфаты цветных металлов, идет в основное производство. Во многих случаях для улучшения растворения цветных металлов шламы проходят предварительную пирометаллургическую подготовку (обжиг, спекание, восстановительную плавку и т.д.).
Переработка шламов методом сульфатизации. Метод основан на том, что сульфиды, оксиды и другие соединения цветных металлов при взаимодействии с концентрированной серной кислотой при температуре выше 150 °С образуют сульфаты, которые при последующем выщелачивании переходят в раствор:
MeS+4H2SO4=MeSO4+4H2O+4SO2;
MeO+H2SO4=MeSO4+H2O;
Me+2H2SO4=MeSO4+2H2O+SO2;
Me2S+6H2SO4=2MeSO4+6H2O+5SO2.
Благородные металлы должны концентрироваться в нерастворимом остатке. Технологическая схема сульфатизации шлама приведена на рис. 2.
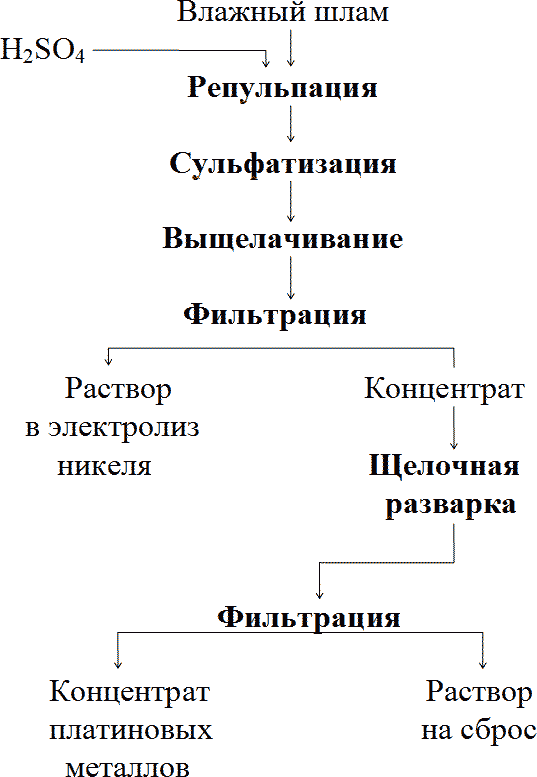
Рис. 2. Сульфатизационное обогащение шламов.
Согласно схеме, шлам репульпируется в серной кислоте при 60-90°С в течение 4-6 ч. При этом в раствор переходит до 30% никеля и меди. Благородные металлы полностью остаются в твердом остатке, который подвергают сульфатизации в течение 10-12 ч при 250-300°С. Сульфаты цветных металлов и железа выщелачиваются водой, а твердый остаток для удаления кремнекислоты обрабатывают в течение 4 ч 4 М раствором щелочи при 80-90°С. Твердый остаток, содержащий до 30% палладия и платины, направляют на аффинаж. Щелочный раствор после нейтрализации сбрасывают.
Эта схема имеет существенный недостаток - при температуре сульфатизации выше 200°С иридий, родий и рутений более, чем на 95% переходят в раствор.
Поэтому предложен способ двойной сульфатизации (рис. 3). Медный и никелевый шламы в принятых пропорциях поступают на первую стадию сульфатизации, проводимую при 180-190°С. Никель, медь, железо более, чем на 99% переходят в раствор. Платиновые металлы практически полностью остаются в нерастворимом остатке. Концентрация платины в растворе не превышает 0.01 мг/л.
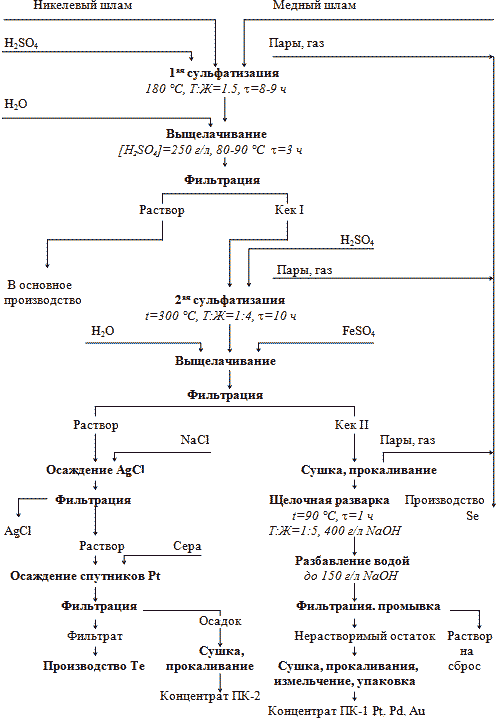
Рис. 3. Принципиальная технологическая схема переработки медных и никелевых шламов методом двойной сульфатизации.
***