Советский физик академик Алексей Васильевич Шубников (1887—1970), чье имя носит основанный им Институт кристаллографии АН СССР, мы представляем читателям его статью «Парадоксы физики», напечатанную в журнале «Наука и жизнь» № 6, 1936 г.
Опыт, описанный А. В. Шубниковым в этой статье, представляет большой интерес и теперь, почти 50 лет спустя. Дело не только в том, что опыт этот связан с интересным, на первый взгляд даже парадоксальным явлением. Не менее важно и то, что он имеет непосредственную связь со вторым началом термодинамики — фундаментальным законом природы, непонимание или даже неточная трактовка которого до сих пор порождает то «невероятное количество ошибок», о которых писал автор статьи.
В числе этих ошибок не только неверная трактовка некоторых опытов, похожих на описанный, но и более серьезные заблуждения, связанные с попытками создать «новую энергетику» путем «концентрации рассеянного тепла окружающей среды». Поэтому редакция сочла полезным повторить публикацию статьи «Парадоксы физики», сопроводив ее комментариями.
Профессор А. ШУБНИКОВ
Всякий, кто прочитал замечательную книгу Я. И. Перельмана «Знаете ли вы физику?» (изд. второе, ОНТИ, 1935 г.), должен почувствовать, как, в сущности, плохо мы умеем пользоваться законами физики даже и тогда, когда мы с полным правом можем считать себя знающими физику.
Идея настоящей заметки возникла после размышления над задачей № 155 из названной книги. В этой задаче спрашивается, можно ли довести воду до кипения, подогревая ее 100-градусным паром. В ответе говорится, что «100-градусным паром можно довести воду до точки кипения, но не до состояния кипения: вода будет оставаться в жидком виде».
Мы прекрасно понимаем, что хотел сказать автор, но полагаем, что ту же мысль он мог бы выразить не в отрицательной, а в положительной форме, например, так:
Стоградусным паром можно довести воду до кипения, ибо этим способом можно нагреть воду до 100° и привести ее в такое состояние, когда пар будет проходить через нее пузырьками, а ведь кипящей водой как раз и называется такая 100-градусная вода, через которую проходят пузырьки пара. Где находится эта 100-градусная вода (несомненно, жидкая, ибо ведь иной-то воды не существует, если термин «вода» употребляется не в химическом, а в физическом смысле), через которую проходят пузырьки пара,— в той же посудине, где образуется пар, или в другой, очевидно, не может быть существенным, особенно если в задаче на этот счет ничего не говорится.
Разобранное нами недоразумение с решением одной из самых простых задач по физике особенно типично для тех научных споров, в основе которых лежит употребление спорящими сторонами обыкновенных слов и научных терминов в неодинаковом смысле». Сущность явления такого рода спорами не затрагивается.
Другое дело, когда в споре обнаруживается глубочайшее незнание того, что кажется хорошо известным обеим сторонам. В этом случае участники спора и посторонние слушатели могут извлечь для себя от дискуссии огромную пользу. Ради этой цели мы позволим себе поставить задачу Я. И. Перельмана более широко: можно ли нагреть 100 градусным паром жидкость выше 100°?
Этот вопрос был предложен 25 лет назад профессором физической химии Крапивиным выпускникам-студентам Московского университета, к которым принадлежал тогда и автор настоящей заметки. С тех пор мне много раз приходилось задавать этот вопрос рядовым физикам и химикам, и не было случая, когда я получил бы правильный ответ. Один из видных химиков так обиделся на мой вопрос, что не пожелал даже продолжать разговор на эту тему, объявив, что сама постановка вопроса может свидетельствовать только о моем глубочайшем невежестве в физике; надо думать, что он причислил меня к сумасшедшим изобретателям перпетуум-мобиле. Дело кончилось тем, что мне пришлось обманом завлечь умного химика в лабораторию, где заранее был приготовлен опыт, показывающий, что 100-градусным паром можно нагреть жидкость до 110° и много выше. Опыт делается очень просто.

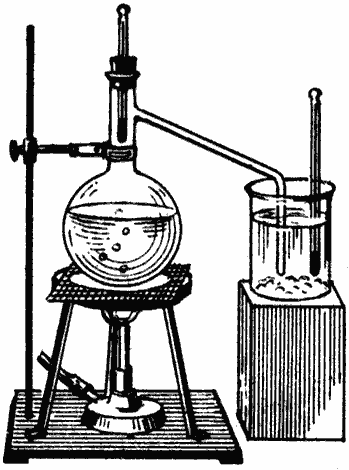
В колбу Вюрца наливается вода (см. рисунок); в горлышко колбы вставляется пробка с термометром, причем шарик термометра, как полагается, помещается возле впая боковой пароотводной трубки колбы; свободный конец этой трубки погружается в насыщенный раствор поваренной соли. В стаканчик с раствором добавлен значительный избыток соли и погружен второй термометр. Для получения скорейшего ответа на поставленный нами вопрос желательно раствор подогреть до опыта, скажем, до 90°.
Когда все приготовления сделаны, нагреваем воду в колбе до кипения и наблюдаем показания обоих термометров. Нетрудно убедиться, что ртуть термометра в колбе, поднявшись до метки 100° (чуть выше или ниже в зависимости от глубины погружения отводной трубки в раствор соли, давления атмосферы и верности термометра), будет оставаться в этом положении все время, пока кипит вода; ртуть же второго термометра будет подниматься до тех пор, пока пар не перестанет конденсироваться в растворе и не начнет проходить через него пузырьками в воздух. Другими словами, температура раствора соли будет подниматься до тех пор, пока он не закипит. Для большей убедительности опыта в этот момент можно поменять термометры местами.
Итак, 100-градусным паром можно нагреть жидкость выше 100°. Как же объяснить этот факт, если «всем известно», что по второму началу термодинамики холодным телом нельзя нагреть горячее?
К счастью, второе начало этого не утверждает, а то, что оно утверждает, к сожалению, способен по-настоящему понять лишь весьма ограниченный круг лиц, если принять во внимание то невероятное количество ошибок, относящихся ко второму началу, которое можно найти не только в курсах физики, но и в курсах термодинамики. Описанное нами явление можно объяснить очень просто.
Если в раствор соли помещен пузырек водяного пара, то он или станет конденсироваться или всплывать на поверхность раствора. Всплывать он может только тогда, когда жидкость нагрета до кипения, ибо кипящая жидкость и есть та самая жидкость, в которой пар (ее собственный, конечно) может всплывать. Но ведь насыщенный раствор соли кипит при 110°. Следовательно, после того как раствор соли будет нагрет до 100°, пары воды будут продолжать конденсироваться в растворе соли. При конденсации пара выделяется тепло (540 кал/г), которое и будет нагревать раствор далее, пока не будет достигнута температура в 110°.
Можно рассуждать и иначе. Упругость водяного пара над раствором при 100° меньше, чем над чистым растворителем (т. е. чем над водой); следовательно, водяной пар, имеющий в кипящей воде упругость в одну атмосферу, не может иметь ту же упругость, попав в раствор. Если же упругость пара меньше атмосферного давления, то он должен конденсироваться в растворе и, выделяя теплоту конденсации, нагревать его.
Если вместо раствора поваренной соли взять более высоко кипящий раствор, то он, очевидно, может быть нагрет паром выше, чем раствор соли.
Само собой разумеется, что сказанное не может иметь приложения к нагреванию парами воды таких жидкостей, которые с водой не дают растворов: например, ртуть нельзя нагреть водяным паром до температуры ее кипения.
КОММЕНТАРИЙ
В статье А. В. Шубникова наряду с описанием опыта дается и его объяснение (даже два варианта). Отмечая, что парадоксальные результаты опыта ни в какой степени не противоречат второму началу термодинамики, автор не раскрывает этого противоречия, ограничившись объяснением процессов взаимодействия пара и жидкости.
В то время (1936 г.) это было, по-видимому, правильно. Второе начало термодинамики вне специальной литературы тогда почти не разбиралось, да и уровень подготовки читателей журнала был намного ниже. Ныне вполне возможно разобрать в научно-популярном журнале «опыт Крапивина» и более доказательно установить: опровергает он второе начало термодинамики или нет?
Правильный ответ на этот вопрос очень важен. Действительно, если признать экспериментально доказанным, что «стоградусным паром можно нагреть жидкость выше 100°С (до 110°С и выше)», то из этого с железной необходимостью следует отмена второго начала термодинамики, которое в принципе запрещает самопроизвольный, без затраты работы, переход тепла от тела с меньшей температурой к телу с более высокой температурой. Но в «опыте Крапивина» именно это и происходит! Пар с температурой 100°С греет соленую воду «до 110°С и выше».
Следствия такой отмены для энергетики, а следовательно, и для техники в целом, были бы необозримы. Становится реальным, как уже давно предлагают некоторые изобретатели, «извлекать тепло из окружающей среды», «концентрировать» его без затраты работы и использовать для нужд человечества. Следовательно, можно будет получать тепло и электроэнергию в неограниченном количестве без затраты химического или ядерного топлива, исключив связанное с их использованием загрязнение окружающей среды. Другими словами, вечный двигатель второго рода, работающий за счет тепла, извлекаемого из окружающей среды, возможен! Остается только удивляться тому, что такой двигатель до сих пор не реализован.
Если же все это не так, и второе начало термодинамики не отменяется, то остается непонятным, как «стоградусный пар» нагревает воду до «110°С и выше». Опыт, действительно, дает такой результат! Где же истина?
Вопрос, несомненно, заслуживает того, чтобы в нем разобраться. Сделать это нужно с особой тщательностью, поскольку в такого рода задачах любая самая маленькая неточность может привести к большим ошибкам.
Начнем поэтому с терминов. Прежде чем разбирать вопрос по существу, отметим одну небольшую, но очень существенную неточность в самом названии опыта. Строго говоря, в опыте производится не «нагрев стоградусным паром жидкости до 110°С и выше», а нечто более сложное.
Чтобы наглядно показать это, представим опыт в таком виде, чтобы он точно соответствовал названию. Тогда колба с нагреваемой жидкостью выглядела бы немного иначе — как показано на втором рисунке.

Пар нужно было бы пропустить по змеевику, не смешивая его с соленой водой в стакане, а только нагревая ее через стенку трубки. Вот тогда был бы действительно «нагрев стоградусным паром» жидкости в стакане. И если бы в этих условиях жидкость — соленая вода — нагрелась до 110° С, то второму началу тут же пришел бы конец, к радости всех изобретателей вечного двигателя. Но, увы, этого не произойдет. При таком устройстве прибора любая жидкость, в том числе и соленая вода, никогда не нагреется выше температуры пара — 100°С. Любой желающий может легко это проверить. Выходит, что тот «химик-скептик», которого Шубников обманом затащил в лабораторию, был абсолютно прав в своем возмущении: «нагреть» (в точном смысле этого слова) «стоградусным паром» рассол до 110°С, конечно, нельзя.
Теперь мы можем вернуться к «опыту Крапивина» и рассмотреть его точно в том виде, как он описан в статье. Здесь происходит не просто нагрев, а смешение водяного пара с соленой водой. В этом, как уже не трудно догадаться, вся «соль» вопроса. Пузырьки пара, как совершенно правильно объясняет А. В. Шубников, конденсируются в растворе соли, все время разбавляя его. При этом лежащая на дне сосуда соль постепенно переходит в раствор, поддерживая его в состоянии, близком к насыщению. Эти два процесса растворения — пузырьков пара в рассоле и соли в нем — и приводят к нагреванию рассола до температуры, существенно более высокой, чем 100°С. Однако нагрев может продолжаться только до тех пор, пока на дне сосуда будет оставаться соль. Как только последний кристалл соли перейдет в раствор, его температура начнет снижаться и постепенно, по мере разбавления, приближаться к 100°С; в конце концов температуры пара и воды сравняются, и с «нарушением второго начала» все будет кончено.
Тепловой эффект, возникающий при взаимном растворении газов, жидкостей и твердых тел, хорошо известен. Он может сопровождаться как охлаждением (например, при смешении льда и соли), так и нагреванием (скажем, при смешении этилового спирта и воды).
Разогрев рассола в «опыте Крапивина» до температуры выше 100°С не имеет никакого отношения к «передаче тепла наоборот» — от более холодного тела к теплому — и, следовательно, к нарушению второго начала.
Все дело именно в теплоте растворения, дающей добавочный эффект разогрева, Можно сказать, что соль, смешиваясь с водой, «отдает свой долг» — то тепло, которое было затрачено на ее отделение от воды при добыче из раствора.
Таким образом, «опыт Крапивина» вопреки первому впечатлению не опровергает, а, напротив, подтверждает правильность второго начала термодинамики.
Следует здесь отметить, что описанный Шубниковым опыт не единственный пример этого рода.
В печати до сих пор встречаются примеры явлений или устройств, якобы опровергающих второе начало термодинамики; при этом авторы, в отличие от А. В. Шубникова, не в состоянии разобраться в существе дела, полагая очередной раз, что «низвержение» неприятных запретов второго начала наконец состоялось. Особенно не везет в этом отношении тепловому насосу — нагревательному устройству, которое исправно выполняет свою работу в полном согласии со всеми законами природы, в том числе и вторым началом. Это лишний раз подчеркивает необходимость точного научного анализа любого, даже парадоксального факта, чтобы не направлять поиски нового по ложному пути и не создавать ненужных сенсаций.
Доктор технических наук В. БРОДЯНСКИЙ
На сайте Претич повторена, с комментарием В.М. Бродянского, публикация А.В. Шубникова ПАРАДОКСЫ ФИЗИКИ, впервые напечатанная в журнале «Наука и жизнь» № 6, 1936 г. В преамбуле и в комментарии подчеркивается связь описываемого в статье опыта Крапивина с фундаментальным законом природы – вторым началом термодинамики, «непонимание или неточная трактовка которого до сих пор порождает невероятное количество ошибок».
Опыт состоит в пропускании водяного пара с температурой 1000 через насыщенный раствор соли в воде, который при этом нагревается до 1100. Заявленная цель статьи состоит в разъяснении того, что опыт не противоречит второму началу термодинамики. Как указывает автор, «при конденсации пара выделяется тепло (540 кал/г), которое и будет нагревать раствор далее, пока не будет достигнута температура в 110°», и далее: «…разумеется, что сказанное не может иметь приложения к нагреванию парами воды таких жидкостей, которые с водой не дают растворов» (курсив мой – А.Ш.)
В. Бродянский в своем комментарии отмечает, что в статье не раскрыты важные детали кажущегося парадокса, и указывает: «вопрос … заслуживает того, чтобы в нем разобраться … с особой тщательностью, поскольку в такого рода задачах любая самая маленькая неточность может привести к большим ошибкам».
Далее он предлагает свое толкование, где говорится: «…здесь происходит не просто нагрев, а смешение водяного пара с соленой водой … в этом … вся «соль» вопроса … соль, смешиваясь с водой, «отдает свой долг» — то тепло, которое было затрачено на ее отделение от воды при добыче из раствора».
В дальнейшем тексте авторов статьи и комментария именую «Ш.» и «Б.».
В статье Ш., действительно, кое-чего недостает для полноты объяснения, но все его утверждения совершенно справедливы, а формулировки точны. В комментарии Б., претендующем на более полное разъяснение парадокса, есть удачные дидактические находки (видоизмененный вариант эксперимента), но главные пробелы статьи Ш. им не только не заполнены, но и внесена дополнительная неточность. Совершенно правильному указанию Ш. на источник тепла для перегрева – теплоту конденсации водяного пара, Б. противопоставляет неверное утверждение, что таким источником является теплота растворения соли. Может быть, он хотел сказать нечто другое, но из текста следует именно это.
Но вопрос об источнике тепла вообще не имеет отношения к парадоксу: он проясняет соблюдение первого начала термодинамики, парадокс же состоит в кажущемся нарушении второго начала.
Здесь все дело, действительно, в смешении – в этом Б. совершенно прав, хотя и Ш. упоминает о том же (см. выделенный курсивом фрагмент цитаты). Но оба автора не указывают главного: при растворении соли в воде возрастает энтропия. В этом (а не в количестве тепла) и состоит «отдача долга»: при отделении соли от воды их суммарная энтропия уменьшилась (разумеется, за счет ее увеличения в технологическом процессе выпаривания в целом). Этого-то уточнения и недостает как в статье, так и в комментарии.
Энтропия относится к числу понятий, плохо освоенных большинством изучавших ее в курсах физики или термодинамики. Традиционное введение энтропии через цикл Карно – главная причина непонимания. Связывать ее с этим циклом можно лишь после основательного знакомства на более простом примере. Поэтому прилагаю презентацию с популярным разъяснением, не претендующим на новизну. Также прилагаю начало учебного пособия по химической термодинамике. В ближайшем будущем оно будет выложено полностью.
Александр Борисович Шур
11.03.2008